Junio 2009
El manejo moderno de los embarazos de alto riesgo y la notable mejoría de la resolución ultrasonográfica han expandido las indicaciones de la sonografía prenatal, permitiendo un mayor número de diagnósticos prenatales de malformaciones congénitas quirúrgicamente corregibles.1
En un estudio de 12,865 sonogramas en 4,551 gestantes durante un período de 21 meses, se refirieron 221 pacientes con 234 anomalías fetales. De éstas, 49% fueron al cirujano pediatra. Otras consultas fueron urológicas (36%), neuroquirúrgicas (9%) y ortopédicas (6%).2 Debido a que los diagnósticos urológicos son usualmente manejados en forma expectante al nacer, la gran cantidad de diagnósticos que abarca la cirugía pediátrica general justifican su estudio detallado, incluyendo Gastrosquisis, Onfalocele, Hernia Diafragmática, Malformación Adenomatoide Quística Congénita, Secuestros Pulmonares, Quistes Ováricos, Teratoma Sacro-coccígeo, Higroma Quístico, Atresia Esofágica y Obstrucciones Intestinales.
El diagnóstico prenatal requiere una pronta consulta por los especialistas que tendrán que ver con el manejo de la anomalía, pues los padres y familiares son presas de pánico, ansiedad, complejos de culpa y de una necesidad imperiosa por encontrar respuestas a sus justificadas preguntas para tomar decisiones informadas. Los estudios genéticos y la ecocardiografía fetal son indicados de acuerdo con la patología encontrada.1
En un reciente estudio por Davenport y colaboradores en Londres, se evaluó el impacto de la consulta prenatal sobre la ansiedad de los padres causada por el diagnóstico de una malformación fetal. El bien diseñado estudio demostró que los niveles de ansiedad de los padres afectados, luego de la consulta prenatal, disminuyeron a valores similares a gestantes controles3.
Revisemos los más frecuentes diagnósticos quirúrgico-pediátricos, haciendo énfasis en su moderno manejo prenatal y perinatal.
Gastrosquisis
Es una emergencia neonatal caracterizada por evisceración de asas intestinales a través de un defecto congénito de la pared abdominal anterior, localizado a la derecha del cordón umbilical. No hay saco amniótico. El intestino está acortado y su pared engrosada por serositis química crónica. El diagnóstico prenatal es posible después de la 14ª semana. En los Estados Unidos, 70% de gastrosquisis son diagnosticadas durante el período prenatal.
Manejo prenatal
Lo usual es llevar a cabo ecografías seriadas. La experiencia del autor con 65 casos es contraria a la inducción de un parto prematuro, a menos que se observen asas intestinales dilatadas, sugestivas de un proceso obstructivo.
Las gestantes presentan elevación de alfa-fetoproteína y gonadotropina coriónica séricas. Raramente es necesaria una amniocentesis para detectar la típica elevación de la acetil-colinoesterasa amniótica.4
Como la embriogénesis es tardía (8ª – 10ª semanas) las anomalías observadas no son tan severas como en el onfalocele pero ocurren en 20% de los casos, de los cuales las atresias intestinales son las más frecuentes. La consulta o consejo prenatal es muy deseable, toda vez que el manejo perinatal está bien establecido, la mortalidad es menor del 4% y el pronóstico es muy satisfactorio. El parto puede ser vaginal o por cesárea, pues no se han observado diferencias significativas en el manejo del recién nacido, a menos que las ecografías seriadas indiquen obstrucción intestinal.5
Manejo perinatal
Se basa en el siguiente protocolo al nacimiento:
El cierre primario varía con la experiencia del cirujano y puede alcanzar un 75% de frecuencia. El cordón umbilical es preservado rutinariamente desde 1986. El tratamiento secundario se realiza colocando una bolsa de silástico reforzada con dacrón, lo que permite la reducción gradual de la evisceración y el cierre definitivo en 7 a 10 días. Estos y otros detalles del manejo de esta compleja malformación son idealmente discutidos con los padres con la debida antelación. El autor operó 65 neonatos con gastrosquisis, obteniendo 100% de supervivencia y excelentes resultados con un seguimiento promedio de 72 meses.4
Onfalocele
Esta anomalía se distingue de la gastrosquisis por la presencia de un saco amniótico, la implantación separada de los elementos del cordón y sobre todo, por una mayor incidencia de malformaciones asociadas severas, tales como cardiopatías y cromosomopatías. En los onfaloceles grandes, el hígado es extracelómico y el saco puede romperse al nacimiento, por lo que se recomienda un parto cesáreo.
Manejo prenatal
El diagnóstico prenatal es también temprano, siendo el descarte de malformaciones asociadas más urgente que en gastrosquisis. La amniocentesis es indicada para descartar defectos cromosomiales de pronóstico sombrío, tales como las trisomías 18 y 13. La ecocardiografía fetal seriada es también necesaria. La terminación del embarazo no es infrecuente en onfaloceles con anomalías severas: 24 de 83 embarazos (29%) fueron terminados, según un reporte de Montreal.6
La determinación sonográfica de hígado extra o intracelómico tiene connotaciones pronósticas: La supervivencia de onfaloceles con hígado extracelómico fue 48%, y con hígado intracelómico, 82%; las cardiopatías asociadas más severas ocurrieron en el primer grupo.6
La información acumulada en las últimas dos décadas confiere al consejo prenatal una importancia decisiva. La experiencia del cirujano pediatra ayuda a los padres a comprender mejor las implicancias del diagnóstico fetal. Naturalmente, el consejo genético, perinatal y de las otras disciplinas participantes, facilitan a los padres tomar decisiones realistas e inteligentes.
Manejo perinatal
Los onfaloceles extracelómicos requieren claramente un parto cesáreo, fundamentalmente para evitar laceraciones hepáticas que usualmente son fatales. Los avances en ecocardiografía fetal han permitido estudios seriados altamente detallados, lo que permite intervenciones perinatales muy precoces en ausencia de malformaciones asociadas severas, obviando la introducción de aire gastrointestinal y logrando una rápida reducción del onfalocele7.
Hernia Diafragmática
Es un defecto congénito que se desarrolla entre la 4ª y 8ª semanas de edad gestacional, al persistir el foramen de Bochdalek. Incidencia 1:2500-5000 nacidos vivos. 80-90% ocurren en el lado izquierdo. Solo 10-15% tienen saco herniario. La alteración fundamental es la hipoplasia pulmonar, que se define como la presencia de 6-8 generaciones bronquiales (normal=15). Importante es la gran cantidad de anomalías asociadas (40-45%), entre las que destacan hipoplasia cardíaca, hidronefrosis, espina bífida, onfalocele, dismorfia facial y cromosomopatías severas.
La mortalidad perinatal actual es de 35-40% si hay hipoxia severa y 7% sin ella. Otras causas frecuentes de mortalidad son anomalías asociadas letales, hipoplasia pulmonar severa, barotrauma y sangrado en el sistema nervioso central.
Manejo pre-natal
Uno de los avances motivados por la ecografía prenatal es la formulación de factores pronósticos de la hernia diafragmática fetal, los cuales constituyen importante información para los padres. Los principales factores son:
- Diagnóstico prenatal, pues ha permitido descubrir la “mortalidad oculta” de la enfermedad. Esto explica las antiguas altas cifras de supervivencia de pacientes diagnosticados durante el período neonatal, ya que solo eran operados los sobrevivientes de la severa dificultad respiratoria de las primeras horas. En un estudio colectivo de 13 hospitales escandinavos, la mortalidad de pacientes con sintomatología temprana y diagnóstico prenatal fue 3.7 veces mayor que en los sintomáticos tempranos sin diagnóstico prenatal. Comparando pacientes con hernias aisladas y con malformaciones asociadas severas, con o sin dx prenatal, la mortalidad fue 52% vs 21% (aisladas, con o sin dx prenatal) y 94% vs 45% (con malformaciones asociadas, con o sin dx prenatal), respectivamente.8
- Hernia diafragmática derecha. En el estudio escandinavo, la mortalidad comparativa de 33 hernias derechas y 134 izquierdas fue 51.5% vs 32%, respectivamente.
- Hígado torácico. La herniación del hígado en el tórax estuvo acompañada de una mortalidad de 65% en una serie europea publicada recientemente.9
- Cociente neumo-cefálico (Fig 7). (En inglés, lung-to-head ratio, o LHR). Fue publicado por el grupo de San Francisco en 1997, presentando 15 fetos con hernia diafragmática izquierda en los que se practicó sonografía entre las 24 y 26 semanas de edad gestacional, dividiendo el área pulmonar derecha a nivel cardiaco entre la circunferencia cefálica. El LHR varió entre 0.62 y 1.86, detectándose tres grupos pronósticos: a) LHR < 1.0, no sobrevivientes; b) LHR 1.0-1.4, 38% sobrevida; c) LHR>1.4, 100% sobrevida. Siete (47%) de los 15 pacientes sobrevivieron.10 Es importante aclarar que la obtención e interpretación del LHR no ha podido ser duplicado por otros centros expertos en el manejo de hernias diafragmáticas, al punto que su valor pronóstico no es aceptado por la mayoría.11-13
- Estimación del volumen pulmonar. Otro marcador indirecto que se discute actualmente es el PPLV (percentage of predicted lung volumen), definido como el volumen pulmonar total dividido por el volumen pulmonar predicho y luego multiplicado por 100. Esta medición se obtiene mediante una Resonancia Magnética (múltiple, inyección única, técnica rápida, imágenes con T1). Valores superiores a 20 indican un buen pronóstico y no requieren ECMO; valores inferiores a 15 son una indicación para “EXIT a ECMO” que discutiremos más adelante.11,14
- Hidropesía fetal. La incidencia la hidropesía fetal en hernia diafragmática es alrededor del 2% y tiene una alta mortalidad. En 2002, el grupo de San Francisco publicó 15 casos de 474 interconsultas. Diez de los 15 casos constituyeron hidropesías verdaderas, es decir, incluían efusiones pleurales y peritoneales así como edema de piel y cuero cabelludo. Cinco de los casos estaban asociados con anomalías letales y fallecieron en el período prenatal. Seis fetos fueron sometidos a intervención prenatal (5 oclusiones traqueales y un drenaje pleuro-peritoneal). Cinco neonatos fallecieron luego del parto y 5 sobrevivieron a largo plazo (2-8 años).15
- Apgar < 6 a los 5 minutos. Este es un factor que con frecuencia va asociado con hipoplasia pulmonar y con otros, forma parte de un puntaje predictivo de alto riesgo de mortalidad.16
Manejo perinatal
La última década ha sido testigo de importantes avances terapéuticos en la hernia diafragmática:
- Estabilización y cirugía electiva. Desde la introducción del ECMO (extracorporeal membrane oxygenation) en 1982, el reparo emergente de la hernia diafragmática dio paso a un manejo cardiorrespiratorio preliminar, con o sin ECMO, seguido en pocos días del acto operatorio. La supervivencia aumentó alrededor del 60-65%17 y se mantuvo cuando la aparición de los respiradores de alta frecuencia decrecieron el empleo de ECMO.
- “Ventilación suave”. Superado el concepto quirúrgico emergente, quedaba el concepto de la agresiva terapia de la hipertensión pulmonar persistente neonatal. Es en la última década que se reconoce la importancia del barotrauma como posible yatrogenia. El advenimiento de los respiradores de alta frecuencia (HFOV, high frequency oscillatory ventilation y HFPPV, high frecuency positive pressure ventilation) permitieron no solo controlar el barotrauma sino también disminuir marcadamente el uso de ECMO (46% a 13% en series representativas), lo cual permitió incrementar la supervivencia a números nunca antes soñados con esta enfermedad (84.4%, excluyendo 18 de 120 casos no tratados por motivos extremos).18
- Hipercapnea permisiva. En 1994, Stolar publicó sus excelentes resultados con un grupo de pacientes en los que se evitó normalizar el pCO2 a expensas de un barotrauma significativo.19 Este concepto forma parte del tratamiento moderno de la hernia diafragmática. Más recientemente, la importancia pronóstica del LHR ha sido cuestionada: En 2007 Stolar presentó un grupo de 28 pacientes con solo hernia diafragmática izquierda, sin cardiopatía u otras malformaciones severas; el LHR de 11 fetos fue < 1.0 y el de 17 >1.0. A pesar de que la sobrevida post natal de ambos grupos (8/11 ó 73% y 16/17 ó 94%) no fue estadísticamente significativa (P 0.114), la sobrevida de los 28 pacientes fue un excelente 86%.12
- Ventilación oscilatoria de alta frecuencia y óxido nítrico inspirado. En un principio, como se describe líneas arriba, la VOAF revolucionó el manejo respiratorio neonatal. Pronto, se encontró que el uso concomitante de óxido nítrico inspirado y surfactante exógeno (cuando se encontraba deficiente) no solo controlaron la hipertensión pulmonar persistente, sino disminuyeron la necesidad de usar ECMO a 3% de los casos. Adicionalmente, esta combinación de iNO y VOAF se completó con cirugía temprana (0.8 ± 1.1 días) y 16 (94%) de los 17 pacientes así tratados sobrevivieron.20 Obviamente, una experiencia mayor es necesaria.
- Fetoterapia. Los escasos éxitos de la cirugía fetal con hernia diafragmática de hace dos décadas fueron seguidos con el descubrimiento de que la ligadura traqueal fetal evitaba el escape de líquido pulmonar normal, lo cual estimulaba el crecimiento del pulmón y disminuía la hipoplasia e hipertensión pulmonar en la hernia diafragmática experimental.21 El año 2003, el grupo de San Francisco presentó su experiencia de 19 casos tratados con el Fetendo (fetal endoscopic) clip; la mortalidad fue 47% pero la morbilidad fue numerosa y en algunos casos severa.22 Finalmente, en el 2006 aparece un reporte multi-institucional (belga, español e inglés) con 24 bloqueos traqueales mediante balones insertados por vía percutánea; la mortalidad fue 50% y la morbilidad fue escasa.9 En la actualidad el grupo europeo ha alcanzado una supervivencia de 57% con LHR´s entre 0.5 y 0.9.23
- EXIT y ECMO combinados. En 2007 el grupo de Boston (Wilson) reporta la combinación de EXIT (ex utero intrapartum treatment) con ECMO (extracorporeal membrane oxigenation) para hernia diafragmática severa (hígado herniado, LHR>1.4, PPLV < 15, cardiopatía congénita). De 90 hernias diafragmáticas fetales durante un período de 6 años, 18 fueron consideradas severas, el manejo descrito se realizó en 11 pacientes y la sobrevida de éstos fue 64%. Los autores reconocen la dificultad para obtener e interpretar el LHR, promoviendo en cambio el PPLV o percentage of predicted lung volume, Sin embargo, el seguimiento a un año mostró que 57% de los infantes seguían recibiendo diuréticos y broncodilatadores.11
Enfermedad Quística Pulmonar
Dentro de las malformaciones pulmonares congénitas, los quistes son los más susceptibles de ser diagnosticados prenatalmente, siendo la malformación adenomatoide quística congénita y los secuestros pulmonares los más frecuentemente encontrados.
Los primeros diagnósticos sonográficos de estas anomalías quísticas se hicieron en la década pasada. Pronto, los secuestros pulmonares y la displasia adenomatoide quística congénita fueron publicados con frecuencia. Sin embargo, diferentes diagnósticos patológicos en la pieza operatoria, han originado la nomenclatura global de Patología Quística Pulmonar.24,25
Manejo prenatal
En la malformación adenomatoide, el diagnóstico y control prenatal ha permitido observar un 15-20% de regresión espontánea.26,27 Asimismo, la sonografía prenatal permite descubrir factores de mal pronóstico tales como hidropesía fetal, polihidramnios, desviación del mediastino, mayor solidez y tamaño de la lesión.28
De todos ellos, el más importante es la hidropesía, con una frecuencia de 10-20% que usualmente causa la muerte fetal.29,25 Recientemente se han reportado intervenciones fetales, como shunts y aspiración de efusiones pleurales.30,25 En 2003, el grupo de San Francisco, reportó tres fetos diagnosticados entre las semanas 20 y 24, que presentaron DAQC y severa hidropesía. La familia rehusó la intervención fetal y las madres recibieron betametasona 12mg IM por dos días consecutivos, entre las semanas 21 y 26. Sorprendentemente, la hidropesía desapareció y los pacientes no exhibieron SDR al nacer.31 En 2007, San Francisco publicó un estudio sobre la incidencia y manejo de la hidropesía en 294 fetos con lesiones expansivas: 180 malformaciones adenomatoides, 23 secuestros broncopulmonares y 4 masas pulmonares. De 96 casos encontrados con hidropesía, 54 tenían una masa torácica, lo cual daba una incidencia de 30% de hidropesía en fetos con malformación adenomatoide, mayor que la estimada anteriormente. Los autores recomendaron intervención fetal si la hidropesía se descubre antes de la 32ava semana, pues en 23 fetos obtuvieron una sobrevida de 57%.32
Existen dos formas de secuestros pulmonares, intralobar y extralobar, siendo ésta la más frecuentemente diagnosticada en el período prenatal. El empleo del doppler permite la identificación de la circulación sistémica de los secuestros, aunque también se ha reportado en algunos casos de malformación adenomatoide. La sonografía antenatal de los secuestros pulmonares también ha permitido detectar, en el 50% de los casos, un espectro de anomalías asociadas, tales como secuestros extralobares e intralobares, malformación adenomatoide, quiste broncogénico, atresia de esófago, hernia diafragmática y hendidura traqueo-esofágica.
Manejo perinatal
En la malformación adenomatoide, el manejo está bien establecido. La mitad de los casos son asintomáticos al nacimiento.28 Los casos sintomáticos son operados al nacer. Los asintomáticos son investigados con tomografía computerizada, incluso en forma seriada, pues las lesiones escapan la radiografía convencional. Al seguimiento, se han reportado infecciones recurrentes e, incluso, blastomas y rabdomiosarcomas pulmonares.28,34
En 2008, el grupo de Filadelfia reportó 105 lesiones quísticas pulmonares fetales, todos asintomáticos al nacimiento. Considerando que estos neonatos tenían gran potencial para infección, neumotórax y hemotórax, que al presente existen más de 40 casos malignos reportados y que 8.6% de cáncer pulmonar en niños presentaban quistes en el período neonatal, todos estos pacientes fueron tratados quirúrgicamente al nacer, con 0% mortalidad y 6% de mínima morbilidad.33
Al nacer, 85% de los secuestros son asintomáticos y el diagnóstico preoperatorio es correcto solo en el 60%.24 La hidropesía fetal también complica los secuestros y, a pesar de su grave pronóstico, se han reportado 3 casos exitosamente tratados al nacer.35
El grupo de Montreal publicó su experiencia en 2008. 29 del total de 45 pacientes fueron diagnosticados prenatalmente. La malformación adenomatoide fue la patología más frecuente, pero también incluyeron 7 enfisemas lobares y 3 secuestros. Ellos también confirman la baja morbilidad de los pacientes asintomáticos al nacer, pero recomiendan lobectomías después de los tres meses, para acortar el tiempo de extubación post operatoria.36
Seguimiento de quistes pulmonares con diagnóstico prenatal. En 2004, Davenport publicó un estudio de 67 fetos con diagnóstico prenatal de enfermedad quística pulmonar. El diagnóstico se hizo entre las 19 y 28 semanas de edad gestacional (promedio=21). Las lesiones ocupaban el hemitórax derecho (29), izquierdo (36) o eran bilaterales (2) y fueron clasificadas sonográficamente como macroquistes (27), microquistes (35) o mixtas (5). Treinta desplazaban el mediastino (45% del total) y 5 presentaron hidropesía (7% del total), motivando cuatro intervenciones prenatales.
64 fetos nacieron vivos, de los cuales 42 (63%) fueron operados a edades que variaron desde un día a 34 meses (promedio de 7.5 meses).
| Histología: | Malf. Adenomatoide 25 (60%) (Stocker I 8, II 13, indeterminado 4) |
| Secuestro pulmonar 6 (14%) | |
| Mixtos 11 (26%) |
Finalmente, el autor no encontró valor pronóstico prenatal en el polihidramnios o la desviación del mediastino, más sí en la hidropesía fetal, que se convirtió en la única indicación para realizar una intervención antenatal. Por otro lado, alertó que las lesiones microquísticas, si bien pueden regresionar y hasta desaparecer intra-útero, hay que seguirlas radiográficamente en el período postnatal, aún con tomografías computerizadas, pues 45% de estas lesiones que desaparecieron intra-útero tuvieron que ser operadas después del nacimiento.25
Quistes Ováricos
Son los tumores abdominales más frecuentes en recién nacidas.37 La incidencia de quistes ováricos en recién nacidas puede estar alrededor del 30%, cifra obtenida en un estudio de nonatas y neonatas fallecidas durante el primer mes de vida.38 La mayoría de estos quistes son pequeños y desaparecen en unas pocas semanas. La ultrasonografía moderna ha permitido un incremento marcado en el diagnóstico de quistes ováricos in útero, ya sean simples o complicados, influenciando marcadamente su manejo.39
Los quistes ováricos prenatales son generalmente diagnosticados entre la 28 y 38 semanas. Lo importante es que pueden regresionar espontáneamente, ya sea en el período antenatal (53%) o postnatal (47%).39 Sin embargo, en los quistes >5cm la torsión ocurre en al menos 20-35% de ellos.40
La patogénesis no está del todo aclarada, pero apunta a sobre-estimulación del ovario fetal, ya sea por FSH de la pituitaria fetal, por los estrógenos maternos o la gonadotropina coriónica placentaria.39-43 Es importante recordar que los quistes ováricos fetales han sido encontrados en ciertas condiciones maternas asociadas con placentomegalia, con la consiguiente sobreproducción de hCG, tales como la diabetes materna, isoinmunización por Rh e hipertensión gravídica.43
Los criterios sonográficos para diagnosticar un quiste ovárico fetal son: sexo femenino, localización en hemiabdomen bajo, imagen aperistáltica y que la vejiga urinaria y los riñones sean visibles. Asimismo, los quistes pueden ser anecoicos (simples) o ecogénicos (complicado, con nivel líquido, septado, coágulo retraído o con ecogenia global).38,44
Manejo prenatal
La experiencia de los últimos quince años ha permitido afinar el manejo de los quistes fetales descubiertos sonográficamente. Hacia 1990, los quistes eran observados pues muchos regresionaban, pero si al nacer medían más de 5cm de diámetro eran extirpados, encontrándose varios casos ya torsionados.41,42,45 A fines de la década del 90 se publican las primeras aspiraciones intraútero.37,46 En 2001, Mittermayer publicó su experiencia con 61 fetos, encontrando 14 casos nacidos con torsión a pesar de haber practicado aspiración intraútero en dos fetos con quistes ováricos; el autor recomendó aspiración prenatal para quistes >5cm.47 Bagolan publica en 2002 un estudio de 73 quistes en 72 fetos, en los que encontró un 34% de quistes complicados, los cuales medían de 3.2 a 6cm, con un promedio de 4.1cm; por lo tanto, refuerza el concepto de Mittermayer y propone aspiración prenatal de los quistes > 4cm. En la actualidad, Bagolan está culminando un estudio prospectivo, iniciado en Enero 2002 y que pretende determinar el efecto de la aspiración del quiste ovárico fetal para prevenir su torsión.
En conclusión, si el quiste mide 4cm de diámetro o más, aspirar: si es < 4cm, vigilarlo con sonogramas seriados.
Manejo perinatal
Si hay evidencia de torsión, cistectomía tratando de preservar ovario. Si no hay torsión y el quiste mide < 4cm, observar con sonogramas seriados; si el diámetro es 4 o más, aspirar.
Teratomas Sacro-Coccígeos
Con una incidencia de 1:35000 nacidos vivos, es el tumor sólido neonatal más frecuente. Se origina de células totipotenciales localizadas en el cóccix y pueden alcanzar gran tamaño. 80% de los pacientes son del sexo femenino.48 De acuerdo a su localización, se clasifican en: I Externo (47%), II Externo y pélvico (34%), III Externo y abdominal (9%), IV Abdómino-pélvico (10%).49 La patología evidencia tumoraciones sólidas y quísticas y 90% son benignos. La malignidad es característica de tumores más sólidos, de presentación más tardía e histología característica de coriocarcinoma o carcinoma endodermal (yolk sac tumor). Son muy vascularizados. La apariencia ecográfica es característica.
Se ha reportado 18% de malformaciones asociadas, incluyendo músculo-esqueléticas, sistema nervioso central, cardíacas y gastrointestinales.49
Manejo prenatal
En los últimos 15 años, el diagnóstico prenatal ha descubierto una “mortalidad oculta” en teratomas sacrococcígeos, en forma similar a la de la hernia diafragmática. En 1990 apareció un estudio colectivo de 48 casos de TSC fetales, en el que reportaba 23% de abortos terapéuticos, 23% de mortalidad intrauterina, 12% de muerte perinatal y solo 20% de supervivencia. Los factores pronósticos relacionados con muerte fetal fueron placentomegalia e hidropesía. Sin embargo, otro hallazgo significativo comenzó a difundirse, la insuficiencia cardiaca fetal por un gasto aumentado debido a la gran vascularidad tumoral.50 Estos hallazgos se repitieron en publicaciones siguientes51,52 hasta que en los últimos tres años han aparecido limitadas pero exitosas experiencias en intervenciones fetales. El grupo de Philadelphia reportó 14 casos: 4 resecciones quirúrgicas, 3 amnio-reducciones, 1 amnio-infusión y 6 aspiraciones quísticas; la supervivencia fue 85%.53 Los 12 casos del grupo Londinense consistieron en 4 obliteraciones por laser, 3 esclerosis por alcohol, 2 drenajes quísticos, 2 drenajes amnióticos y una derivación amniótica, con 50% de sobrevida.54
En resumen, no hay duda que el pronóstico de los TSC diagnosticados en el período prenatal es mucho más severo que los encontrados después del nacimiento. El manejo del TSC fetal debe incluir atención especial a los más sólidos (menos quísticos) debido a su mayor vascularidad, así como a la presencia de placentomegalia y la aparición de hidropesía. Estos hallazgos requieren sonogramas seriados y la determinación de maduración pulmonar fetal, a fin de programar una oportuna intervención cesárea.
Manejo perinatal
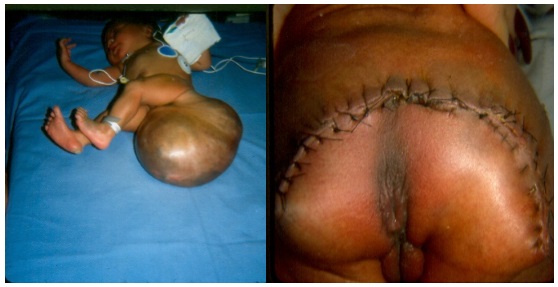
Las figuras muestran un típico teratoma sacro-coccígeo y su tratamiento exitoso perinatal. Es importante incluir el cóccix en continuidad con el tumor.
Teratoma Cervical
En 1988, Jordan y Gauderer55 reportaron 9 casos vistos en Cleveland entre 1929 y 1987 y encontraron 212 casos en una revisión de la literatura, proponiendo 5 categorías:
| I | Natimuertos | 12% del total |
| II | Neonato con SDR | 45% del total, 43% mortalidad |
| III | Neonato sin SDR | 17% del total, 2.7% mortalidad |
| IV | Un mes a 18 años | 14% del total, 3.2% mortalidad |
| V | Adultos | 10% del total, 43% mortalidad, 69% malignidad |
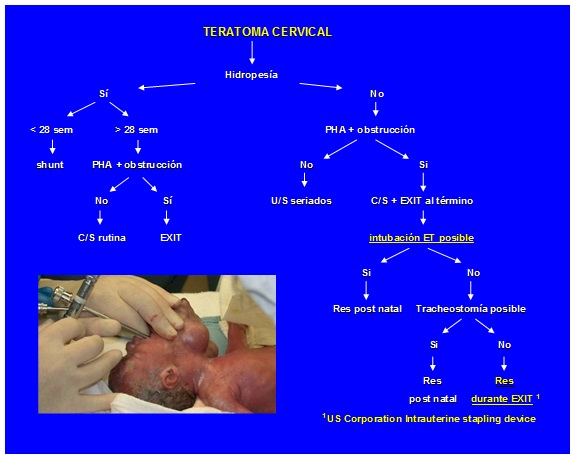
Los teratomas cervicales constituyen un 3% de los teratomas del neonato.56,57 A diferencia de los teratomas sacrococcígeos, no hay predominancia sexual. Usualmente, las masas tumorales son sólidas y quísticas y ocupan una posición anterior, aunque pueden crecer rápidamente y entonces tienen un desplazamiento lateral. Al nacimiento, estos tumores son benignos pero la obstrucción de las vías aéreas es la complicación más seria, por lo que el diagnóstico prenatal es crucial. La obstrucción del esófago produce polihidramnios y A-V shunts intratumoral causan hidropesía fetal. Hay una importante incidencia de muerte intrauterina. La ultrasonografía y la resonancia magnética son evaluaciones prenatales importantes.58
Manejo prenatal
Durante el manejo prenatal, el tamaño del tumor adquiere importancia pronóstica. Masas >8-10 cms de diámetro están asociadas con muerte fetal por hidropesía, o un curso con polihidramnios y prematuridad. Al nacer, la dificultad reaspiratoria es evidente y la intubación endotraqueal es frecuentemente imposible. En estos casos extremos, el procedimiento llamado EXIT (ex-utero intrapartum treatment), aplicado por primera vez en 1996, constituye un refinamiento exitoso en algunos casos selectos (7 casos reportados en 2002).58,59
Manejo perinatal
Tres principales centros fetales de los Estados Unidos (San Francisco CA, Washington DC, St. Louis MO) aconsejan el siguiente protocolo:
Higroma Quístico
Es una malformación linfática multilocular que ocurre en 1:12000 nacimientos. Se presenta en el cuello en 75-80% de los casos. Otras localizaciones son axilar (20%), cérvico-mediastinal (3-10%), retroperitoneo y vísceras abdominales (2%) y una miscelánea que incluye a extremidades, huesos, pared torácica, ingle, escroto, mesenterio y parótida (2%).60
Manejo prenatal
Una vez más, el diagnóstico prenatal, especialmente si se logra antes de la 30ª semana, tiene una connotación pronóstica muy diferente a diagnósticos más tardíos. En una publicación de 1990, 27 de 29 fetos fueron diagnosticados con higroma quístico antes de la 30ª semana. 2 tuvieron regresión espontánea y al nacer presentaron síndrome de Noonan (fenotipia parecida al Turner, pero con cromosomas normales y cardiopatías), falleciendo uno en el período neonatal por insuficiencia cardíaca. De los 25 que no experimentaron regresión espontánea, 18 presentaron anomalías asociadas severas y 21 tuvieron hidropesía y/o linfangiomatosis difusa; de este grupo de 25 fetos, 4 tuvieron aborto espontáneo y 21 aborto terapéutico. Dos pacientes fueron diagnosticados después de la 30ª semana, no tenían anomalías asociadas y sobrevivieron al tratamiento quirúrgico neonatal.61
Los hallazgos descritos arriba se han repetido hasta el presente. Hay, definitivamente, una mortalidad oculta en esta condición, durante el período prenatal. La hidropesía fetal, frecuentemente asociada a linfangiomatosis difusa, tiene un pésimo pronóstico. Recientemente, Thomas ha indicado diferentes categorías pronósticas: a) < 13 semanas, cariotipo normal, buen pronóstico; b) < 13 semanas, cariotipo anormal, mal pronóstico; c) 14-29 semanas, pronóstico de cuidado o malo; >30 semanas, buen pronóstico.62
Manejo perinatal
El tratamiento es quirúrgico, especialmente en las localizaciones submandibulares que con frecuencia desencadenan cuadros obstructivos de las vías aéreas en el período neonatal. Los higromas no involucionan como los hemangiomas, por lo que no es conveniente diferir su tratamiento.
Atresia de Esófago
Se incluye esta anomalía para destacar la relación que el polihidramnios tiene con la atresia pura de esófago (sin fístula traqueoesofágica), que ocurre en 8% de los casos. En un estudio publicado en 2001, se hizo énfasis en el hallazgo ecográfico de un estómago pequeño o ausente asociados a un polihidramnios y se recomendó completar el estudio sonográfico prenatal con una resonancia magnética. Se estudiaron 10 fetos y el scan se consideró positivo si se demostraba dilatación proximal o esófago distal ausente. 4 scans fueron negativos y los neonatos tenían esófagos normales. De los 6 scans positivos, 5 nacieron con atresia de esófago (2 con fístula y 3 sin fístula).63
Obstrucción Intestinal Neonatal
En general, las malformaciones abdominales tienen un pronóstico más favorable que los problemas torácicos. Las atresias duodenales muestran la característica “doble burbuja” y las más distales muestran grados variables de dilatación intestinal. El diagnóstico diferencial no es posible en muchos casos. Sin embargo, la presencia de polihidramnios, ascitis fetal, calcificaciones peritoneales y quistes intra-abdominales, son característicos de peritonitis meconial. Además, los casos de íleo meconial no complicado demuestran un aumento marcado de la ecogenicidad del abdomen fetal, debido al espesamiento del meconio.64
Bibliografía
- Uceda JE: Diagnóstico prenatal en Cirugía Pediátrica. Revista Peruana de Pediatría 59: 28-35, 2006
- Crombleholme TM & al: Prenatal diagnosis and the pediatric surgeon: The impact of prenatal consultation on perinatal management. J Pediatr Surg 31: 156-163, 1996
- Kemp J, Davenport M & al: Antenatally diagnosed surgical anomalies: The psychological effect of parental antenatal counseling. J Pediatr Surg 33: 1376-1379, 1998
- Uceda JE: Gastrosquisis: Experiencia personal con 65 casos. XIII Congreso Peruano de Cirugía Pediátrica. Lima, Febrero 2002
- Langer JC et al: Etiology of intestinal damage in gastroschisis. I: Effect of amniotic fluid exposure and bowel constriction in a fetal lamb model. J Pediatr Surg 24: 992-997, 1989
- St Vil D & al: Chromosomal anomalies in newborns with omphalocele. J Pediatr Surg 31: 831-834, 1996
- Uceda JE: Umbilical preservation in omphalocele repair. J Pediatr Surg 29: 1412-1413, 1994
- Skari H & al: Congenital diaphragmatic hernia in Scandinavia from 1995 to 1998: Predictors of mortality. J Pediatr Surg 37: 1269-1275, 2002
- Deprest J & al: Current consequences of prenatal diagnosis of congenital diaphragmatic hernia. J Pediatr Surg 41: 423-430, 2006
- Lipshutz G & al: Prospective analysis of lung-to-head ratio predicts survival for patients with prenatally diagnosed congenital diaphragmatic hernia. J Pediatr Surg 32: 1634-1636, 1997
- Kunisaki SM & al: Ex utero intrapartum treatment with extracorporeal membrane oxygenation for severe congenital diaphragmatic hernia. J Pediatr Surg 42: 98-106, 2007
- Arkovitz MS & al: Fetal lung-head ratio is not related to outcome for antenatal diagnosed congenital diaphragmatic hernia. J Pediatr Surg 42: 197-111, 2007
- Rescorla FJ: What´s new in Pediatric surgery? J. Pediatr Surg 44: 43-52, 2009
- Büsing KA & al: Magnetic resonance relative Fetal Lung Volume in congenital diaphragmatic hernia: Survival and need for extracorporeal membrane oxygenation. Radiology 248: 240-246, 2008
- Sydorak RM & al: Congenital diaphragmatic hernia and hydrops: A lethal association? J Pediatr Surg 37: 1678-1680, 2002
- Haricharan RN & al: Identifying neonates at a very high risk for mortality among children with congenital diaphragmatic hernia managed with extracorporeal membrane oxygenation. J Pediatr Surg 44: 87-93, 2009
- Clark RH & al: Current surgical management of congenital diaphragmatic hernia: A report from the CDH study group. J Pediatr Surg 33: 1004-1009, 1998
- Boloker J & al: Congenital diaphragmatic hernia in 120 infants treated consecutively with permissive hypercapnea/spontaneous respiration/elective repair. J Pediatr Surg 37: 357-366, 2002
- Wung JT & al: Survival with congenital diaphragmatic hernia treated with delayed surgery, spontaneous respiration and no tube thoracostomy (Abstract). Pediatr Res 35: 261A, 1994
- Okuyama H & al: Inhaled nitric oxide with early surgery improves the outcome of antenatally diagnosed congenital diaphragmatic hernia. J Pediatr Surg 37: 1188-1190, 2002
- Wilson JM & al: Experimental fetal tracheal ligation prevents the pulmonary hypoplasia associated with fetal nephrectomy: Possible application for congenital diaphragmatic hernia. J Pediatr Surg 28: 1433-1440, 1993
- Harrison MR & al: Fetoscopic temporary tracheal occlusion for congenital diaphragmatic hernia: Prelude to a randomized, controlled trial. J Pediatr Surg 38: 1012-1020, 2003
- Jani JC & al: Fetal lung to head ratio in the prediction of survival in severe left sided diaphragmatic hernia treated by fetal endoscopic tracheal occlusion. Am J Obstet Gynecol 195: 1646-1650, 2006
- Bratu I & al: The multiple facets of pulmonary sequestration. J Pediatr Surg 36: 784-790, 2001
- Davenport M & al: Current outcome of antenatally diagnosed cystic lung disease. J: Pediatr Surg 39: 549, 556, 2004
- Roggin KK & al: The unpredictable character of congenital cystic lung lesions. J Pediatr Surg 35: 801-805, 2000
- Butterworth SA & Blair GK: Postnatal spontaneous resolution of congenital cystic adenomatoid malformation. J Pediatr Surg 40: 832-834, 2005
- Sauvat F & al: Management of asymptomatic neonatal cystic adenomatoid malformations. J: Pediatr Surg 38: 548-552, 2003
- Miller JA & al: Congenital cystic adenomatoid malformation in the fetus: Natural history and predictors of outcome. J Pediatr Surg 31: 805-808, 1996
- Crombleholme TM & al: Cystic adenomatoid malformation volume ratio predicts outcome in prenatally diagnosed cystic adenomatoid malformation of the lung. J Pediatr Surg 37: 331-338, 2002
- Tsao K & al: Resolution of hydrops fetalis in congenital cystic adenomatoid malformation after prenatal steroid treatment. J Pediatr Surg 38: 508-510, 2003
- Tsai AY & al: Outcomes after post natal resection of prenatally diagnosed asymptomatic cystic lung lesions. J Pediatr Surg 43: 513-517, 2008
- Grethel EJ & al: Fetal intervention for mass lesions and hydrops improves outcome: A 15-tear experience. J Pediatr Surg 42: 117-123, 2007
- Aziz D & al: Perinatally diagnosed asymptomatic congenital cystic adenomatoid malformation: To resect or not? J Pediatr Surg 39: 329-334, 2004
- Evans MG: Hydrops fetalis and pulmonary sequestration. J Pediatr Surg 31: 761-764, 1996
- Aspirot A & al: A contemporary evaluation of surgical outcome in neonates and infants undergoing lung resection. J Pediatr Surg 43:508-512, 2008
- Crombleholme TM & al: Fetal ovarian cyst decompression to prevent torsion. J Pediatr Surg 32: 1447-1449, 1997
- Meizner I & al: Fetal ovarian cysts: Prenatal ultrasonographic detection and postnatal evaluation and treatment. Am J Obstet Gynecol 164: 874-878, 1991
- Heling KS & al: Fetal ovarian cysts: Prenatal diagnosis, management and postnatal outcome. Ultrasound Obstet Gynecol 20: 47-50, 2002
- Bagolan P & al: The management of fetal ovarian cysts. J Pediatr Surg 37: 25-30, 2002
- Suita & al: Therapeutic dilemmas associated with antenatally detected ovarian cysts. Surg Gynecol & Obstet 171: 502-508, 1990
- Brandt ML & al: Surgical indications in antenatally diagnosed ovarian cysts. J Pediatr Surg 26: 276-282, 1991
- Berezowski AT & al: Prenatal diagnosis of fetal ovarian hyperstimulation. Ultrasound Obstet Gynecol 17: 259-262, 2001
- Nussbaum AR & al: Neonatal ovarian cysts: Sonographic-pathologic correlation. Radiology 168: 817-821, 1988
- Muller C & al: Ovarian cysts in the fetus and the neonate: Changes in sonographic pattern in the follow up and their management. Pediatr Radiol 22: 395-400, 1992
- Perrotin F & al: Fetal ovarian cysts: A report of three cases managed by intra-utero aspiration. Ultrasound Obstet Gynecol 16: 655-659, 2000
- Mittermayer C& al: Fetal ovarian cysts: Development and neonatal outcome. Ultraschall Med 24: 21-26, 2003
- Flake A: Fetal sacrococcygeal teratoma. Seminars Pediatr Surg 2: 113-120, 1993
- Altman RP, Randolph JG, Lilly JR: Sacrococcygeal teratoma: American Academy of Pediatrics Surgical Section-1973. J Pediatr Surg 9: 389-398, 1974
- Bond SJ & al: Death due to high-output cardiac failure in fetal sacrococcygeal teratoma. J Pediatr Surg 25: 1287-1291, 1990
- Holterman A & al: The natural history of sacrococcygeal teratomas diagnosed through routine obstetric sonogram: A single institution experience. J Pediatr Surg 33: 899-903, 1998
- Kamata S & al: Operative management for sacrococcygeal teratoma diagnosed in utero. J Pediatr Surg 36: 545-548, 2001
- Hedrick H & al: Sacrococcygeal teratoma: Pre-natal assessment, fetal intervention and outcome. J Pediatr Surg 39: 430-438, 2004
- Makim E & al: Outcome of antenatally diagnosed sacrococcygeal teratomas: Single-center experience (1993-2004)
- Jordan RB, Gauderer MW: Cervical teratomas: An analysis. Literature review and proposed classification. J Pediatr Surg 23: 583-591, 1988
- Grosfeld JL & al: Benign and malignant teratomas in children: Analysis of 85 patients. Surgery 80: 297-305, 1976
- Tapper D, Lack EE: Teratomas in infancy and childhood. A 54 year experience al the Children´s Hospital Medical Center. Ann Surg 198: 398-410, 1983
- Hirose S & al: Spectrum of intrapartum management strategies for giant fetal cervical teratoma. J Pediatr Surg 38: 446-450, 2003
- Bouchard S & al: The EXIT procedure: Experience and outcome in 31 cases. J Pediatr Surg 37: 418-426, 2002
- Fonkalsrud E: Congenital malformations of the lymphatic system. Sem Pediatr Surg 3: 62-69, 1994
- Langer JC & al: Cervical cystic hygroma in the fetus: Clinical spectrum and outcome. J Pediatr Surg 25: 58-62, 1990
- Tzachrista E & Jeauty P: Anterior cystic hygroma. TheFetus.net, articles, 2003
- Langer JC & al: Prenatal diagnosis of esophageal atresia using sonography and magnetic resonance imaging. J Pediatr Surg 36: 804-807, May 2001
- Denholm TA & al: Prenatal sonographic appearance of meconium ileus in twins. Am J Radiology 143: 371-372, 1984