24 Febrero 2009
Concepto
Es una emergencia gastrointestinal neonatal. 90% de los pacientes son prematuros. Se presenta como íleo paralítico, sangrado gastrointestinal bajo y un grado variable de necrosis intestinal que puede llegar a la perforación. Existe una mayor prevalencia en países con mayor incidencia de prematuridad, con excepción de Suiza, países escandinavos y Japón. En neonatos a término, la enfermedad se presenta tempranamente, se localiza en el colon y el Clostridium Perfringes es cultivado con frecuencia.1 En un estudio reciente, la enterocolitis en neonatos a término se ha relacionado con una mayor incidencia de cesáreas.2
Etiopatogenia
Etiología indeterminada. Hay varios mecanismos probables, toda vez que hay casos agudos o insidiosos, generalizados o localizados, y con inflamación severa o leve.
Hay tres mecanismos básicos: Lesión isquémica, colonización bacteriana y un substrato a nivel local intestinal.
Isquemia intestinal
La perfusión intestinal es controlada por dos mecanismos, uno sistémico, relacionado con el gasto cardíaco y otro local, determinado por la necesidad de oxígeno tisular. Ejemplos de situaciones con flujo circulatorio disminuido incluyen a la insuficiencia cardiaca, hiperviscosidad, stress por frío y la acción vasoconstrictora de drogas como la indometacina.
Pero es la reperfusión intestinal la que origina eventos bioquímicos que producen necrosis, dando lugar a que el oxígeno molecular reaccione con leucocitos polimorfonucleares y la enzima oxidasa xantínica para producir radicales libres citotóxicos: Super óxido (O2-), Hidroxilo (OH-) y Peróxido de hidrógeno (H2O2). La lesión celular se produce por peroxidación de la molécula lipídica de la membrana celular.
Colonización bacteriana
Las bacterias de la flora intestinal (E. Coli, Proteus, Klebsiella) son las más frecuentemente identificadas en la ECN neonatal. Sin embargo, también se pueden aislar anaeróbicos o los Clostridium Perfringes o Dificile. Todas estas bacterias pueden colonizar el intestino isquémico o hacen daño a través de sus toxinas.
Este proceso se facilita en las primeras tres semanas de vida del neonato prematuro, pues hay un déficit de linfocitos intestinales B y T y de inmunoglobulina A secretora.
Substrato
La leche materna contiene factores benéficos (macrófagos, Ig A secretora, lactoferrina) que confieren inmunidad pasiva al intestino neonatal. En los casos de ECN, la lactancia con fórmulas es 20 veces más frecuente que la lactancia materna.
La alimentación enteral de prematuros puede dar origen a endotoxemias que, a su vez, estimulan la producción de CITOQUINAS, mediadores inflamatorios que producen un daño significativo a la mucosa intestinal neonatal. Entre las citoquinas más estudiadas tenemos:
La leche materna contiene PAF-acetyl hydrolase, enzima que ataca al PAF. Asimismo, está demostrado que la leche materna contiene Eritropoietina y que ésta puede tener un rol directo en la prevención de la ECN.
Experimentalmente, se ha demostrado que ciertas substancias previenen la necrosis celular, tales como:
La ECN es, pues, una enfermedad compleja y multifactorial. Son factores reconocidos: ISQUEMIA, REPERFUSIÓN, BACTERIAS, TOXINAS BACTERIANAS, CITOQUINAS, ALIMENTACIÓN e INMADUREZ INMUNOLÓGICA.1,3,4
En la actualidad, los únicos consistentes precursores epidemiológicos son la prematuridad y la alimentación enteral. Por otro lado, aún carecemos de marcadores biológicos predictivos de riesgo y severidad en la enterocolitis necrotizante neonatal. En un reciente artículo, se ha propuesto un Modelo Matemático Computerizado como una estrategia para investigar la patogénesis de la enfermedad.5
Diagnóstico
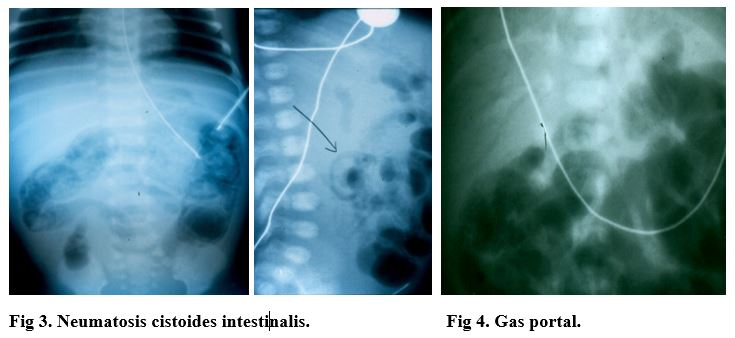
La distensión abdominal con sangrado fecal y neumatosis intestinal (Fig 3) en un prematuro son virtualmente diagnósticos de enterocolitis necrotizante (ECN).
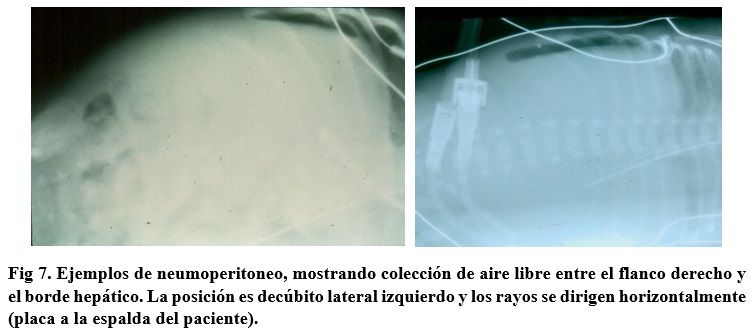
Las manifestaciones clínicas son muy variables. Pueden simular una leve intolerancia alimenticia (distensión abdominal moderada con aumento del residuo gástrico) o presentarse como sepsis neonatal, con ápnea, bradicardia, letargia, hipotermia, peritonitis y shock. En estos casos severos, el laboratorio muestra trombocitopenia, neutropenia y anemia, y la radiología, gas portal (Fig 4), ascitis y neumoperitoneo (Fig 7).
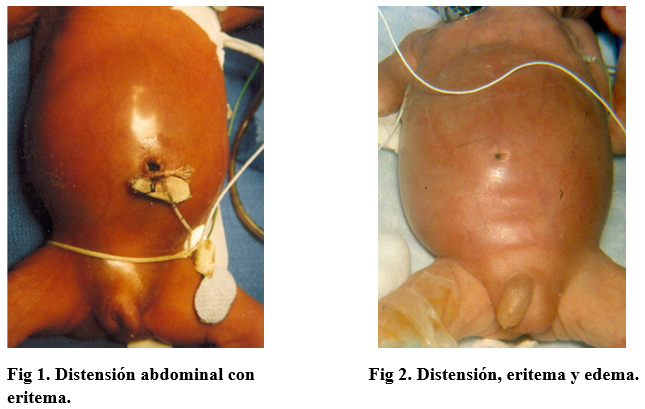
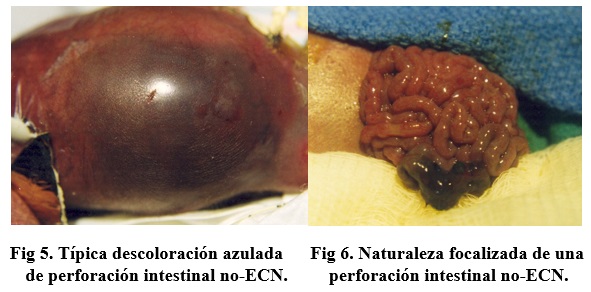
En los últimos 15 años, con la marcada supervivencia de prematuros < 1000 gramos (ELBWI - extremely low birth weight infants) se han identificado perforaciones intestinales localizadas, distintas a la ECN pues la enfermedad es localizada y no hay presencia de neumatosis intestinal o gas portal. Estos infantes presentan una coloración azulada en el abdomen, que es característica. En nuestra experiencia en Dallas, entre 1983 y 2001, operamos 77 pacientes con ECN y 56 con perforaciones no-NEC. Esta aclaración es importante, pues en la literatura se habla de un aumento de los casos de ECN, incluyendo pacientes como los arriba mencionados, cuya incidencia está siendo reconocida con mayor frecuencia.6
Recientemente, se ha publicado un estudio sobre la medición de la velocidad de flujo en la arteria mesentérica superior en el primer día de vida de prematuros en riesgo de contraer ECN.7
Estadíos clínicos de bell
El tratamiento adecuado de la ECN depende del análisis sistemático del cuadro clínico. La clasificación propuesta en 1978 por Bell y Ternberg8 persiste a pesar del tiempo transcurrido:
| ESTADÍO I (Sospecha) | Hx: Stress, letargia, ápneas y bradicardias.
Ex: Residuos, vómitos, distensión abdominal moderada, sangre oculta en heces. Rx: Ileo moderado. |
| ESTADÍO II (Definitivo) | Hx: Stress, letargia, ápneas y bradicardias.
Ex: Residuos, vómitos, distensión abdominal moderada, sangre oculta en heces. Rx: Distensión, íleo, neumatosis, gas portal, edema pared intestinal, ascitis. |
| ESTADÍO III (Avanzado) | Hx: Igual a II
Ex: Igual a II + deterioro clínico, sepsis severa con shock, hemorragia GI. Rx: Igual a II + neumoperitoneo. |
Tratamiento médico
En Unidad de Cuidados Intensivos. Colocar en cama radiante para una mejor observación, manejo y monitoreo Se incluyen los siguientes parámetros:
Cada 8 horas: Examen, Rx abdomen en decúbito lateral izquierdo, recuento de plaquetas
Alteraciones Hematológicas En ECN
En 1976, Hutter describió las anormalidades hematológicas asociadas con ECN. Recientemente, Hutter y Kling actualizaron el tema, incluyendo avances en el conocimiento de su fisiopatología.9
Plaquetas
La incidencia de trombocitopenia en ECN es de 65-90%. El mecanismo más frecuente es el excesivo consumo, que es una respuesta a infección, hipoxia o acidosis.
Plasma activating factor (PAF) es una citoquina fosfolípida producida por el proceso inflamatorio, que contribuye a la necrosis intestinal. Se la encuentra elevada en ECN, a tal punto que una concentración >10.2 ng/ml es predictiva de ECN en 100% de los casos.10
El tratamiento usual consiste en transfusión de plaquetas, aunque la respuesta dura unos 2-3 días. Otros métodos experimentales son la administración de Interleukin-11 y Tpo (thrombocyte-poietin)11
Coagulación
DIC se ha reportado en 28% de los casos. El empleo de Antitrombina III acaba de ser reportado por el grupo de Kansas City, Mo.12
La coagulopatía es frecuentemente tratada con plasma fresco congelado con o sin crioprecipitado. Kreuz ha reportado el uso de heparina en sepsis neonatal, a la dosis de 100 IU/k/d, así como el empleo exitoso de proteina C en 7 neonatos con shock séptico y púrpura fulminante.13
Neutropenia
Definición: < 1500 neutrófilos por mm3. La neutropenia se acompaña de una mortalidad de 50%.
El tratamiento específico incluye G-CSF (granulocyte-colony stimulation factor) y GM-CSF (granulocyte macrophage-colony stimulation factor), aunque los resultados no han sido concluyentes.14,15
Anemia
Es de origen multifactorial pero la más importante es la anemia hemolítica, pues se observa en 60% de los casos severos. La activación del Criptantígeno T está asociada con la hemólisis severa de la ECN. Otras causas de anemia son iatrogénicas (frecuentes muestras de sangre) y la Anemia de la Prematuridad que está relacionada con disminución de la eritropoietina (Epo).
El principal tratamiento es de soporte, con transfusión de eritrocitos lavados. Es importante prevenir la transfusión de productos con anticuerpos a Criptantígeno T a infantes con altas concentraciones de Criptantígeno T.
Tratamiento Quirúrgico
| Indicaciones: | Neumoperitoneo, que es indicativo de perforación.
Deterioro clínico, con sepsis, sangrado e insuficiencia respiratoria progresiva. Trombocitopenia y acidosis metabólica persistentes. Eritema y edema de pared, indicativa de peritonitis. Radiología demostrando ascitis y asa dilatada persistente. |
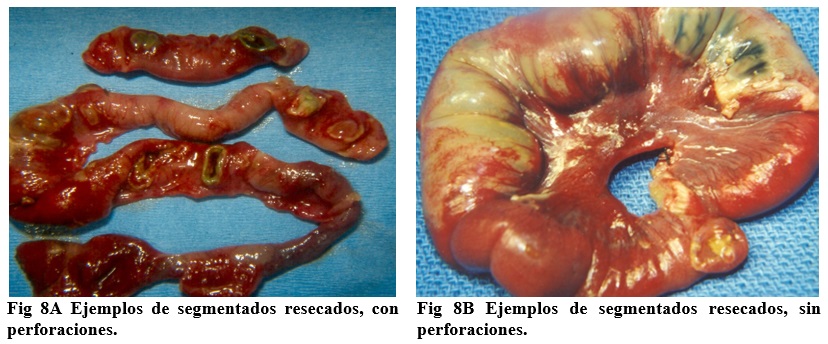
| Principios | Resecar solo necrosis obvia para prevenir síndrome de intestino corto.
En ECN masiva, re-explorar en 12-24 horas, lo cual usualmente se hace en la UCI. Medir siempre el intestino resecado y el remanente, a fin de planificar el manejo postoperatorio. Construir estomas, evitando anastomosis, por riesgo de dehiscencia postoperatoria. Procurar una vía venosa central en 48 horas, para evitar contaminación séptica. El manejo operatorio está ampliamente difundido en la literatura quirúrgica.1,3,16-18 |
Manejo Post Operatorio
El tercer espacio (intra y retroperitoneal, intraluminal y en pared intestinal) está aumentado, particularmente en casos severos de ECN, con la correspondiente pérdida de líquido rico en albúmina. De aquí la necesidad de monitorear la diuresis horaria, la albúmina sérica y la corrección de los desequilibrios hidroelectrolíticos.
El empleo de plasma fresco congelado, (10 cc/k) está indicado en los casos más severos.
La albúmina al 20% (pobre en sal) es imprescindible en pacientes >1500g en dosis de 4 cc/kg, siguiendo de cerca los niveles de albuminemia.
Es deseable una agresiva antibiótico-terapia, cubriendo aeróbicos y anaeróbicos (ceftazidina, ampicilina, gentamicina y clindamicina).
Transfusiones de plaquetas (6 U/m2) son empleadas en forma seriada para controlar la trombocitopenia.
Es importante combatir la acidosis metabólica y mantener una nutrición parenteral central adecuada.
NPO por un mínimo de 10 días, o mientras dure el íleo paralítico.
La re-alimentación oral debe ser progresiva y adecuada a la posición de las estomas. En yeyunostomías, es preferible el gavage continuo en volúmenes pequeños pero incrementando progresivamente la concentración de la fórmula. De esta forma se minimizan las pérdidas de sodio. En las ileostomías se puede instituir progresivamente la alimentación por bolos, cuidando que el drenaje no exceda 30 cc/k/día. En casos de resecciones importantes de ileo distal, la diarrea resultante se maneja con la colesteramina, que es una resina de intercambio iónico que funciona neutralizando las sales biliares. La colesteramina se administra en dosis altas, pudiendo llegar a 3-4 gramos por día en un paciente de 2.5 kilogramos de peso.19
Antes de proceder a la reanastomosis, la radiografía de colon con una sustancia iso-osmótica permite descartar la presencia de estenosis post ECN.
Resultados Del Tratamiento Quirúrgico
Si bien la mortalidad post operatoria ha decrecido progresivamente en las últimas dos décadas, aún se mantiene en niveles importantes debido a un incremento de neonatos de < 1000 gramos, también conocidos como “extremely low birth weight infants”. Alrededor de 20% de estos micro-prematuros presentan necrosis total y 100% de mortalidad.18
Cuando trabajaba en la Universidad de Colorado, el autor estudió 45 casos operados entre 1972 y 1982, encontrando una mortalidad de 38%.19 El grupo de Nuevo Méjico tuvo un 47% de mortalidad en su extensa experiencia de 94 pacientes.20 De Indianápolis, reportaron 83 pacientes con 35% de mortalidad.17 En Porto Alegre se publican 91 pacientes, con 46% de fallecidos.21 Entre 1983 y 2001, el autor operó 77 pacientes con ECN, con una mortalidad de 35%.22 Finalmente, de Jacksonville publican recientemente una mortalidad de 33% para sus 66 infantes operados.23
Drenaje Peritoneal
En 1975, Ein y colaboradores propusieron el drenaje peritoneal bajo anestesia local como alternativa a la laparotomía en microprematuros con severa ECN.24 En 1990 actualizaron su experiencia que ya sumaba 37 pacientes, 88% de los cuales pesaban < 1500g y 65% < 1000g.; si bien reportan que 32% se recuperaron sin otro tratamiento, 24% fallecieron sin que se pudiera hacer una laparotomía, 24% empeoraron y necesitaron laparotomía falleciendo la mitad y 20% desarrollaron obstrucción intestinal que requirió cirugía y un tercio fallecieron; en total, 16 (43%) de los 37 pacientes fallecieron.25 Dos estudios recientes con 11 y 16 pacientes reportaron una mortalidad de 73% y 47%, respectivamente.26,27
Esta modalidad de tratamiento no es practicada comúnmente en la actualidad.
Estenosis Post Enterocolitis Necrotizante
Entre uno a seis meses después de una ECN tratada médicamente, 11-33% de los pacientes pueden presentar una estenosis cicatricial la que compromete el colon en 80% de los casos, especialmente el colon izquierdo, donde se encuentra el 60% de tales estenosis (Fig 9). Las estenosis pueden ser múltiples en 15% de los casos. La histología consiste en una fibrosis submucosa con grados variables de inflamación (Fig 10).
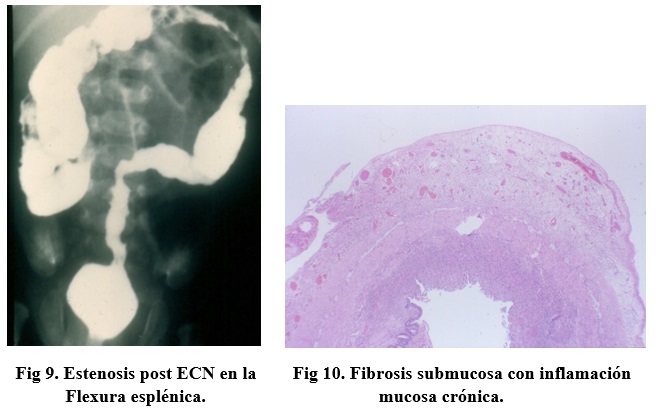
El cuadro clínico corresponde a una obstrucción intestinal baja, parcial o completa. En la mitad de los casos el paciente es asintomático, por lo que el manejo es conservador, pues estudios contrastados seriados han demostrado una completa resolución de la estenosis.
En los infantes con síndrome obstructivo, el tratamiento indicado es resección y anastomosis primaria, aunque en casos extremos, una colostomía temporal puede ser necesaria.28
Resultados Del Tratamiento A Largo Plazo
Del total de neonatos afectados con ECN, 60% se recuperan médicamente. El resto, tiene que ser intervenido quirúrgicamente durante el proceso agudo (30%), o semanas después cuando presentan una estenosis colónica sintomática (10%).
Los resultados a largo plazo no son reportados con frecuencia. Stevenson reportó en 1980 los resultados del tratamiento quirúrgico de 42 pacientes con ECN; 40 fueron seguidos 1-3 años, encontrando un 50% de complicaciones ya sean neurológicas o de retardo en el crecimiento.29 En el estudio de 1982 con 25 pacientes operados en la U. de Colorado, 19 tuvieron un seguimiento de 1-11 años, con un promedio de 3.2 años; 12 estaban creciendo normalmente, pero dos presentaban retardo mental, uno malabsorción y cuatro retardo en el crecimiento; además, se sabía que de los 6 perdidos al seguimiento, uno sufría de espasticidad, uno de sordera y otro de retardo en el crecimiento.19
En 1989, Walsh publica 40 niños con ECN, tratados médica o quirúrgicamente, estableciendo un seguimiento en 36 a los 20 meses de edad: 13 pacientes con ECN grado II sufrían retardo de crecimiento en 15% y complicaciones neurológicas en 5%, mientras que 23 pacientes que tuvieron ECN grado III, experimentaron retardo en crecimiento en 39% y problemas neurológicos en 28%.29
En 2002, el Hospital de Niños de Pittsburgh reporta 103 pacientes con ECN, médicos y quirúrgicos. 61% tuvieron un seguimiento promedio de 7.5 años. Todos tenían < 50 percentil para talla y peso, se alimentaban oralmente y 83% eran escolares a tiempo completo.30
Recientemente, dos publicaciones se ocupan de las secuelas de la ECN en prematuros de bajo peso extremo (ELBWI < 1000g). Del Hospital Parkland en Dallas, comparan 17 prematuros que sufrieron ECN grado II y III con 51 controles sin ECN, estudiados a la edad corregida de 18-22 meses, y concluyeron que la ECN y sus co-morbilidades están asociados con severo retardo en crecimiento y desarrollo neurológico.31 Finalmente, en un estudio retrospectivo y multi-institucional, se evaluaron 124 prematuros con ECN tratada quirúrgicamente, 121 tratados médicamente y 2703 controles, también a 18-22 meses de edad corregida: Los investigadores también encontraron en el grupo quirúrgico un retardo significativo de crecimiento y alteraciones en el desarrollo neurológico.32
Prevención
La severidad que puede alcanzar la enterocolitis necrotizante, especialmente en el prematuro, demanda lógicamente continuados esfuerzos preventivos. Por varios años, se han considerado los esteroides prenatales, lactancia materna y las inmunoglobulinas enterales. Más recientemente se ha propuesto el empleo de factor activante plaquetario.33
La administración de probióticos orales ha cobrado actualidad con la publicación de Lin y colaboradores, en la que se concluye que oral administration of lactobacillus acidophilus and bifidobacterium infantis reduce la incidencia y severidad de la ECN en infantes de muy bajo peso (VLBW < 1500g).34
Bibliografía
- Kosloske AM: Necrotizing enterocolitis. En: Oldham KT et al. Surgery of infants and children. Philadelphia, Lippincott-Raven, 1997:1201
- Maayam-Metzger A, et al: Necrotizing enterocolitis in full term infants: Case control study and review of literature. J Perinatol 24:494-499,2004
- Foglia RP: Necrotizing enterocolitis. Curr Probl Surg 32:766-820,1995
- Ford H: Mechanism of nitric oxide-mediated intestinal barrier failure: Insight into the pathogenesis of necrotizing enterocolitis. J Pediatr Surg 41:294-299,2006
- Upperman JS & al: Mathematical modelling in necrotizing enterocolitis – A new look at an ongoing problem. J Pediatr Surg 42:445-453,2007
- Uceda JE, el al: Intestinal perforations in infants with a very low birth weight: A disease of increasing survival? J Pediatr Surg 30:1314-1316,1995
- Murdoch EM & al: Doppler flow velocity in the superior mesenteric artery on the first day of life in pre term infants and the risk of neonatal necrotizing enterocolitis. Pediatrics 118:1999-2003,2006
- Bell MJ, Ternberg JL, et al: Neonatal necrotizing enterocolitis: Therapeutic decisions based upon clinical staging. Ann Surg 187:1-7, 1978
- Kling PJ, Hutter JJ: Hematologic abnormalities in severe neonatal necrotizing enterocolitis: 25 years later. J Perinatol 25:523-530, 2003
- Rabinowitz SS, et al: Platelet-activating factor in infants at risk for necrotizing enterocolitis. J Pediatr 138:81-86, 2001
- Sola M, et al: Evaluation and treatment of thrombocytopenia in the neonatal intensive care unit. Neonatal Hematol 27:655-679, 2000
- St Peter SD & al: The initial experience of Antithrombin III in the management of neonates with necrotizing enterocolitis. J Pediatr Surg 42:704-708,2007
- Kreuz W, et al: Neonatal sepsis: A challenge in hemostaseology. Semin Thromb Hemost 25:531-535, 1999
- Berstein HM, et al: Administration of recombinant human granulocyte colony stimulation factor to neonates with septicaemia: A meta analysis. J Pediatr 138:917-920, 2001
- Bilgin K, et al: A randomized trial of granulocyte-macrophage colony stimulating factor in neonates with sepsis and neutropenia. Pediatrics 107:36-41, 2001
- Albanese CT, Rowe MI: Necrotizing enterocolitis. In: O’Neill JA Jr, Rowe MI, Grosfeld JL, et al. eds. Pediatric Surgery, 5th ed. St Louis, Mosby, 1998
- Grosfeld JL, et al: Changing trends in necrotizing enterocolitis: Experience with 302 cases in two decades. Ann Surg 214:300-307, 1991
- Rowe, MI, et al: Necrotizing enterocolitis in the extremely low birth weight infant. J Pediatr Surg 29:987-991, 1994
- Uceda JU, Lilly JR, et al: Estudio no publicado
- Kosloske AM: Indications for operation in necrotizing enterocolitis revisited. J Pediatr Surg 29:663-666, 1994
- de Souza JC, et al: Prognostic factors of mortality in newborns with necrotizing enterocolitis submitted to exploratory laparotomy. J Pediatr Surg 36:482-486, 2001
- Uceda, JE: Experiencia personal con 77 casos.
- Sharma R, et al: Portal venous gas and surgical outcome of neonatal necrotizing enterocolitis. J Pediatr Surg 40:371-376, 2005
- Ein SH, et al: Peritoneal drainage under local anesthesia for perforations from necrotizing enterocolitis. J Pediatr Surg 12:963-965, 1977
- Ein SH, et al: A 13-year experience with peritoneal drainage under local anesthesia for necrotizing enterocolitis perforation. J Pediatr Surg 25:1034-1037, 1990
- Dzakovic AD, et al: Primary peritoneal drainage for increasing ventilatory requirements in critically ill neonates with necrotizing enterocolitis. J Pediatr Surg 36:733-735, 2001
- Sharma R, et al: Surgical management of bowel perforations and outcome in VLBWI < 1200g. J Pediatr Surg 39:190-194, 2004
- Balance WA, et al: Pathology of neonatal necrotizing enterocolitis. J Pediatrics 117:S6, 1990
- Walsh MC, et al: Influence on outcome at 2 years of age. Pediatrics 84:808-814, 1989
- Stanford A, et al: Long term follow up of patients with necrotizing enterocolitis. J Pediatr Surg 37:1048-1050, 2002
- Salhaf WA, et al: Necrotizing enterocolitis and neurodevelopmental outcome in ELBWI < 1000g. J Perinatol 24:534-540, 2004
- Hintz S, et al: Neurodevelomental and growth outcomes of ELBWI after necrotizing enterocolitis. Pediatrics 115:696-703, 2005
- Bell EF: Preventing necrotizing enterocolitis: What works and how safe?. Pediatrics 115:173-174, 2005 (commentary)
- Lin HC, et al: Oral probiotics reduce the incidence and severity of necrotizing enterocolitis in VLBWI. Pediatrics 115:1-4, 2005